一、行业相关政策法规
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件。
效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用。
目的是疾病的诊断、预防、监护、治疗或者缓解;损伤的诊断、监护、治疗、缓解或者功能补偿;生理结构或者生理过程的检验、替代、调节或者支持;生命的支持或者维持;妊娠控制;通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
为了鼓励医疗器械行业的研究与创新,促进行业的健康发展,国家制定了一系列的产业政策。
医疗器械行业相关政策法规
日期 | 颁布部门 | 行业政策法规 | 概述 |
2021年 | 家药监局器械注册司 | 关于征求《关于药械组合产品注册有关事宜的通告》(修订草案公开征求意见稿)意见的函 | 随着医药行业的快速发展,以及《药品管理法》《医疗器械监督管理条例》及配套规章的修订和实施,原国家食品药品监督管理局发布的《关于药械组合产品注册有关事宜的通告》(2009年第16号)已不能完全适应现行法律法规和行业发展的需要。为进一步加强药械组合产品注册管理工作,我司组织修订了《关于药械组合产品注册有关事宜的通告》(修订草案公开征求意见稿)。 |
2021年 | 海市药品监督管理局、上海市医疗保障局、上海市卫生健康委员会 | 关于印发《上海市关于联合推进医疗器械唯一标识系统全域试点工作方案》的通知 | 为贯彻落实新修订的《医疗器械监督管理条例》和国务院办公厅《关于印发治理高值医用耗材改革方案的通知》,加强三医联动,进一步提升医疗器械全生命周期监管效能和医疗卫生管理效率,推进医疗器械唯一标识系统全域试点工作,结合本市实际,我们组织制定了《上海市关于联合推进医疗器械唯一标识系统全域试点工作方案》。 |
2021年 | 国家药监局 | 《关于发布影像型超声诊断设备同品种临床评价技术审查指导原则等2项注册技术审查指导原则的通告(2021年第2号)》 | 为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药监局组织制定了影像型超声诊断设备同品种临床评价技术审查指导原则等2项注册技术审查指导原则。 |
2021年 | 北京市药品监督管理局 | 《关于加强对国家集中带量采购中选冠脉支架流通使用环节监管工作的通知》 | 按照《国家药监局综合司关于加强国家集中带量采购中选冠脉支架质量监管工作的通知》(药监综械管〔2020〕103号),以及北京市医疗保障局、北京市卫生健康委员会、北京市药品监督管理局联合印发《北京市落实国家组织冠脉支架集中带量采购工作实施方案的通知》要求,为切实做好国家集中带量采购中选冠脉支架流通使用环节的质量监管。 |
2021年 | 国家药监局 | 《关于发布医用磁共振成像系统同品种临床评价技术审查指导原则(2020年修订版)的通告》 | 为加强医疗器械产品注册工作的监督和指导,进一步提高注册审查质量,国家药监局组织制定了医用磁共振成像系统同品种临床评价技术审查指导原则(2020年修订版)。 |
2021年 | 国家药监局综合司 | 公开征求《医疗器械应急审批程序(修订稿征求意见稿)》意见 | 为进一步做好医疗器械应急审批工作,国家药监局组织对原国家食品药品监督管理局发布的《医疗器械应急审批程序》(国食药监械〔2009〕565号)进行修订,形成了《医疗器械应急审批程序(修订稿征求意见稿)》 |
2021年 | 国家药监局综合司 | 公开征求《医疗器械应急审批程序(修订稿征求意见稿)》意见 | 进一步做好医疗器械应急审批工作,国家药监局组织对原国家食品药品监督管理局发布的《医疗器械应急审批程序》(国食药监械〔2009〕565号)进行修订,形成了《医疗器械应急审批程序(修订稿征求意见稿)》(见附件)。 |
2021年 | 上海市药品监督管理局 | 关于发布《机械心脏瓣膜类医疗器械不良事件报告指南(试行)》等两项通知 | “十三五”期间,我局承担“机械心脏瓣膜”国家医疗器械不良事件重点监测工作。为总结此项工作,我局组织编写了《机械心脏瓣膜类医疗器械不良事件报告指南(试行)》。 |
2021年 | 国家药监局 | 关于发布医疗器械行业标准《口腔胶原膜通用技术要求》的公告 | YY/T1794-2021《口腔胶原膜通用技术要求》医疗器械行业标准已经审定通过,现予以公布。 |
2021年 | 国家药品监督管理局、医疗器械技术审评中心 | 《关于2020年度第二类医疗器械注册技术审查指导原则公开征求意见的通知》 | 根据国家药品监督管理局2020年度医疗器械注册技术审查指导原则项目计划的有关要求,我中心组织编制了《网式雾化器注册技术指导原则》等22个二类指导原则(附件1),现已形成征求意见稿,即日起在网上公开征求意见。 |
2021年 | 国家药监局综合司 | 《关于推荐医疗器械质量抽查检验复检机构的通知》 | 为贯彻落实《医疗器械监督管理条例》有关规定,进一步加强医疗器械质量抽查检验复检工作,现决定开展医疗器械质量抽查检验复检机构推荐工作。 |
2021年 | 上海市药品监督管理局 | 关于印发《医疗器械审评审批提质增效扩能行动方案(2021-2022年)》的通知 | 为贯彻落实习近平总书记关于药品监管、医疗装备产业发展等批示指示精神,更好实施健康中国战略,就深入推进审评审批制度改革,提高本市医疗器械审评审批质量和效率,更大程度激发医疗器械产业发展动力和市场活力,更好满足公众安全用械需求。 |
2021年 | 国家药品监督管理局 | 关于《医疗器械经营监督管理办法(修订草案征求意见稿)》公开征求意见的通知 | 为贯彻《医疗器械监督管理条例》,进一步规范医疗器械经营监督管理工作,我们起草了《医疗器械经营监督管理办法(修订草案征求意见稿)》,现向社会公开征求意见。 |
2021年 | 国家药品监督管理局 | 关于《体外诊断试剂注册管理办法(修订草案征求意见稿)》公开征求意见的通知 | 为贯彻《医疗器械监督管理条例》,进一步规范医疗器械生产监督管理工作,我们起草了《体外诊断试剂注册管理办法(修订草案征求意见稿)》,现向社会公开征求意见。 |
2021年 | 国家药监局综合司 | 《关于开展医疗器械质量安全风险隐患排查治理工作的通知》 | 2021年是中国共产党成立100周年,也是实施“十四五”规划,全面建设社会主义现代化国家新征程的开启之年。按照2021年全国医疗器械监督管理工作会议部署,为深入贯彻落实“四个最严”要求,强化医疗器械风险管理,进一步提升质量安全保障水平,推动我国医疗器械产业高质量发展。 |
2021年 | 国家药品监督管理局、国家标准化管理委员会 | 《关于进一步促进医疗器械标准化工作高质量发展的意见》 | 医疗器械安全与人民群众身体健康和生命安全息息相关,是健康中国的重要组成部分。近年来,医疗器械科技和产业迅猛发展,医疗器械监管改革深入推进,创新、质量、效率持续提升,医疗器械标准化工作发挥了重要的基础保障作用。为贯彻十九届五中全会精神,落实党中央、国务院关于标准化工作改革决策部署,坚持科学化、法治化、国际化、现代化发展方向,以高标准夯实医疗器械监管和产业高质量发展基础,更好发挥标准在制械大国向制械强国跨越中的支撑和引领作用。 |
2021年 | 国家药监局综合司 | 《关于印发医疗器械注册人备案人开展不良事件监测工作检查要点的通知》 | 为贯彻实施《医疗器械不良事件监测和再评价管理办法》,落实医疗器械注册人备案人主体责任,加强医疗器械不良事件监测检查工作,国家药监局组织制定了《医疗器械注册人备案人开展不良事件监测工作检查要点》,以规范和指导对医疗器械注册人备案人的质量管理体系检查、不良事件监测专项检查、日常监督检查等工作。 |
2021年 | 国家药监局综合司 | 《关于印发2021年国家医疗器械抽检产品检验方案的通知》 | 各省、自治区、直辖市药品监督管理局及新疆生产建设兵团药品监督管理局(下简称省局)、中国食品药品检定研究院应按照《2021年国家医疗器械抽检品种检验方案》(附件1)组织相关检验机构按医疗器械强制性标准以及经注册或者备案的产品技术要求(注册产品标准)开展检验工作。 |
2021年 | 北京市药品监督管理局 | 关于对《北京市药品监督管理局关于取消境内第一类医疗器械产品备案有关规定的通告》公开征集意见的公告 | 为进一步做好第一类医疗器械备案管理工作,强化备案人主体责任,保障公众用械安全,北京市药品监督管理局制定了《关于取消境内第一类医疗器械产品备案有关规定的通告(征求意见稿)》。 |
2021年 | 国家药监局综合司 | 《关于印发国家医疗器械质量抽查检验工作程序的通知》 | 为规范国家医疗器械质量抽查检验工作,依据《医疗器械监督管理条例》和《医疗器械质量抽查检验管理办法》(国药监械管〔2020〕9号),国家药监局组织起草了《国家医疗器械质量抽查检验工作程序》。 |
2021年 | 国家药品监督管理局药品审评中心 | 关于发布《用于产生真实世界证据的真实世界数据指导原则(试行)》的通告 | 为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,药审中心组织制定了《用于产生真实世界证据的真实世界数据指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品技术指导原则发布程序的通知》(药监综药管〔2020〕9号)要求,经国家药品监督管理局审查同意,现予发布,自发布之日起施行。 |
2021年 | 国家药监局 | 《关于发布重组胶原蛋白类医疗产品分类界定原则的通告(2021年第27号)》 | 为进一步加强重组胶原蛋白类医疗产品监督管理,推动产业高质量发展,国家药监局组织制定了《重组胶原蛋白类医疗产品分类界定原则》。 |
资料来源:智研咨询整理
二、医疗器械生产企业
智研咨询发布的《2021-2027年中国医疗器械产业发展态势及投资决策建议报告》显示:2017-2020年上海市医疗器械生产企业数量呈增长趋势,2017年上海市医疗器械生产企业数量915家,至2020年上海市医疗器械生产企业数量963家,较2017年增加48家。
2017-2020年上海市医疗器械生产企业数量
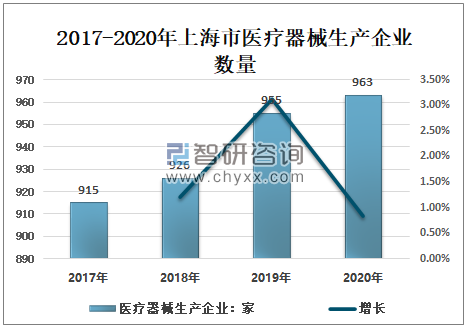
资料来源:上海市药品监督管理局、智研咨询整理
2019年上海市医疗器械生产企业数量955家,其中:一类医疗器械生产企业255家,占26.70%,二类医疗器械生产企业497家,占52%,三类医疗器械生产企业203家,占21.30%;2020年上海市医疗器械生产企业数量963家,其中:一类医疗器械生产企业296家,占30.70%,二类医疗器械生产企业453家,占47%,三类医疗器械生产企业214家,占22.20%。
2017-2020年上海市医疗器械生产企业数量(按类别)
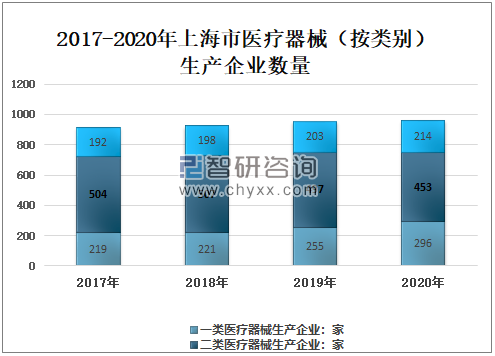
资料来源:上海市药品监督管理局、智研咨询整理
2017-2020年上海市医疗器械生产企业数量按类别分布
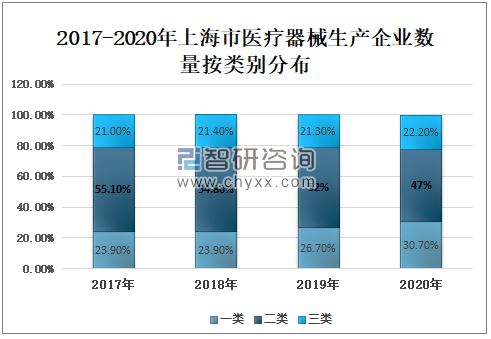
资料来源:上海市药品监督管理局、智研咨询整理
2020年上海市有源医疗器械生产企业数量331家,较2019年减少73家,占26.80%;无菌医疗器械生产企业数量128家,较2019年增加14家,占14.70%;口腔医疗器械生产企业数量119家,较2019年减少17家,占10.60%;试剂医疗器械生产企业数量103家,较2019年减少8家,占9.90%;植入医疗器械生产企业数量53家,较2019年增加2家,占9.90%;软件医疗器械生产企业数量25家,与2019年持平,占2.60%。
2015-2020年上海市各跨类别医疗器械生产企业数量(单位:家)
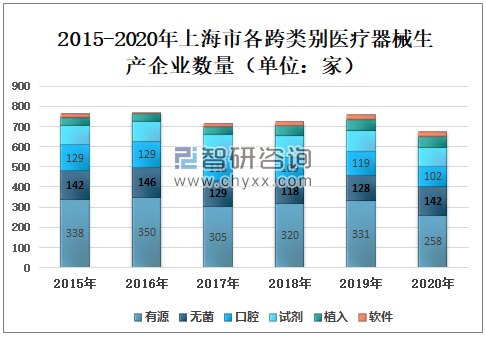
资料来源:上海市药品监督管理局、智研咨询整理
2015-2020年上海市跨类别医疗器械生产企业数量占比
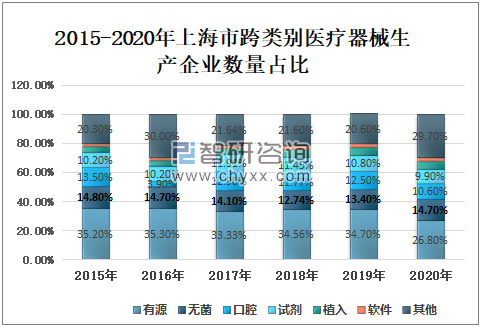
资料来源:上海市药品监督管理局、智研咨询整理
2019年上海市医疗器械生产企业开办许可35家,变更462家次,换证109家;2020年上海市医疗器械生产企业开办许可105家,变更664家次,换证146家。
2015-2020年上海市医疗器械生产企业许可和注销情况
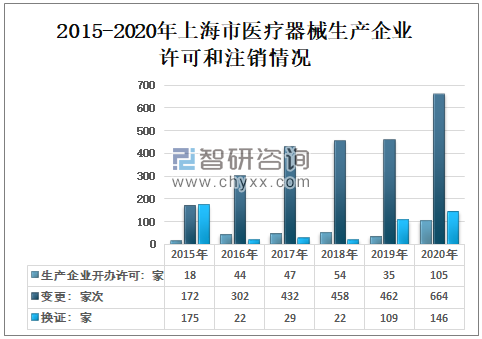
资料来源:上海市药品监督管理局、智研咨询整理
三、经营企业
2017-2020年期间,上海市医疗器械经营企业数量呈逐年增长,2020年,海市医疗器械经营企业数量33332家,较2019年增加5712家;持有医疗器械经营许可证(同时含二类备案凭证)企业13270家,较2019年增加2594家;仅持有二类备案凭证企业16681家,较2019年增加3486家。
2015-2020年上海市医疗器械经营企业数量
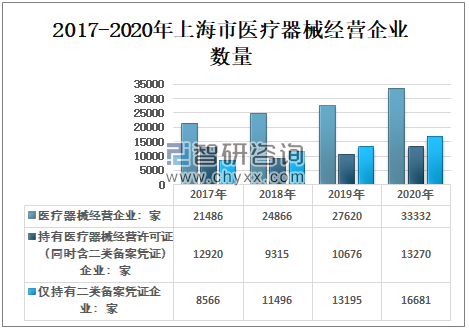
资料来源:上海市药品监督管理局、智研咨询整理
2019年上海市医疗器械生产企业开办许可35家,变更462家次,换证延续109家;2020年上海市医疗器械生产企业开办许可105家,变更664家次,换证延续146家。
2015-2020年上海市医疗器械生产企业办证情况
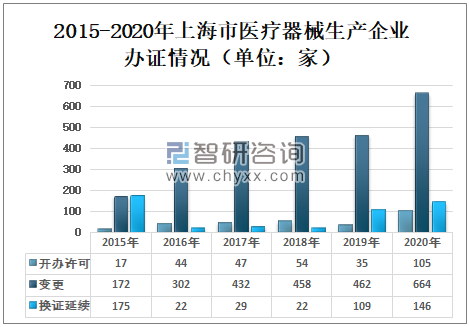
资料来源:上海市药品监督管理局、智研咨询整理
 智研咨询 - 精品报告
智研咨询 - 精品报告

2025-2031年中国耳鼻喉医疗器械行业市场运行态势及发展趋势研判报告
《2025-2031年中国耳鼻喉医疗器械行业市场运行态势及发展趋势研判报告》共十一章,包含中国耳鼻喉医疗器械行业代表性企业布局案例研究,中国耳鼻喉医疗器械行业市场前景预测及发展趋势,中国耳鼻喉医疗器械行业投资战略规划策略及建议等内容。

 公众号
公众号
 小程序
小程序
 微信咨询
微信咨询





















